Chirurgia corneale (per la cura del cheratocono)
“Cheratocono: un passo avanti”
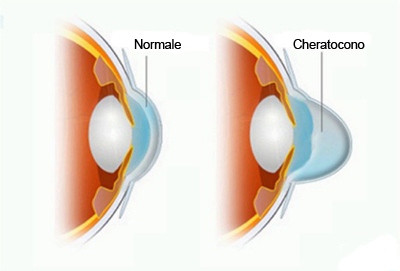
E’ stata introdotta in Italia una nuova terapia ‘eziopatogenetica’ del cheratocono. Tale tecnica è denominata Cross-linking corneale e consente di rinforzare il tessuto collagene della cornea attraverso l’impiego combinato di una sostanza fotosensibile nota come riboflavina o vitamina B2 e irradiazione ultravioletta di tipo UV-A a basso dosaggio allo scopo di contrastare la progressione del cheratocono. La nuova terapia si è rivelata in grado di rallentare e bloccare l’evoluzione del cheratocono e di migliorare la visione nel 70% dei pazienti trattati, per un incremento della simmetria ed una regolarizzazione della forma della cornea.
Chi è un buon candidato?
Le persone con uno spessore corneale superiore ai 400 micron (anche se è stato fatto su persone che avevano una spessore corneale di 240 micron, usando acqua distillata per rendere la cornea spessa fino a 400 micron durante il trattamento), con valori cheratometrici inferiori a 70 diottrie, che non abbiano evidenti cicatrici corneali centrali, che non abbiano avuto infezioni oculari da herpes simplex o zoster, che non siano in gravidanza (a causa della variazione del processo di guarigione).
Almeno il 90% delle persone con cheratocono in un occhio sviluppa poi la malattia anche nell’altro occhio; per tale motivo, si preferisce trattare da subito entrambi gli occhi, anche se il cheratocono è presente in maniera conclamata in un occhio solo. Ciò è dovuto proprio al fatto che i rischi sono considerati estremamente contenuti ed è molto più facile prevenire la progressione della malattia piuttosto che riportare alla normalità un occhio dopo che questo è diventato “anormale”.
Domande frequenti
– E’ una tecnica invasiva?
Non è una tecnica invasiva: il trattamento viene effettuato sulla superficie della cornea, e la riboflavina serve proprio per proteggere le strutture sottostanti.
– Il cross-linking e’ da considerarsi ancora in fase sperimentale?
Una tecnica chirurgica ufficialmente approvata come il cross linking corneale non è da considerarsi sperimentale. Con “ufficialmente approvata” è da intendersi che ne è stato approvato l’uso ovunque dai comitati etici, essendo considerata una tecnica pressoché esente da rischi .
– Tra le diverse cause che potrebbero indurre a fare il cross-linking… c’è anche quella della non tolleranza alla lenti a contatto?
Conviene eseguire il trattamento prima che si giunga all’intolleranza alle lenti a contatto, ma anche questo può essere un buon motivo per prendere la decisione.
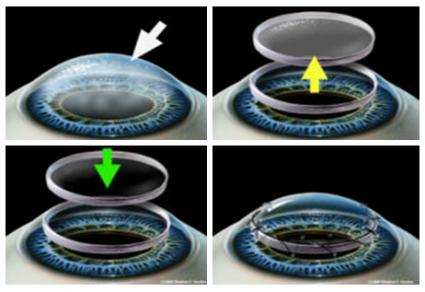
Trapianto di cornea (cheratoplastica perforante)
Ottiche: per migliorare le qualità ottiche della cornea e migliorare quindi la visione; p. es., sostituire una cornea opaca/cicatrizzata a causa di una distrofia corneale stromale o una cornea con astigmatismo irregolare dovuto a un cheratocono.
Ricostruttive: per ricostruire la cornea anatomica e salvare l’occhio, p. es., sostituendo una cornea perforata.
Terapeutiche: per trattare patologie che non rispondono alla terapia medica allo scopo di preservare l’occhio, p. es., terapia per gravi ulcere corneali micotiche incontrollabili o per alleviare il dolore, p. es., ridurre la forte sensazione di corpo estraneo dovuto alla rottura ricorrente delle bolle nella cheratopatia bollosa.
Le più comuni indicazioni, in ordine decrescente, sono la cheratopatia bollosa (pseudofachia, distrofia endoteliale di Fuchs, afachia), ilcheratocono, innesto ripetuto, cheratiti/post-cheratiti(virali, batteriche, fungine, Acanthamoeba, perforazione) e distrofie corneali stromali.
Selezione del tessuto del donatore
Il confronto del tessuto non viene eseguito di routine o non è necessario nella maggior parte dei trapianti di cornea. Il tessuto corneale dei donatori nelle seguenti condizioni non viene utilizzato per i trapianti: morte per causa sconosciuta, malattia di Creutzfeldt-Jakob, panencefalite subacuta sclerosante, leucoencefalite progressiva multifocale, rosolia congenita, encefalite attiva, setticemia attiva, endocardite attiva, sifilide attiva, epatite virale o sieropositività, rabbia, sieropositività per l’HIV o alto rischio di infezione da HIV, leucemie, linfomi attivi disseminati, precedenti interventi chirurgici sul segmento anteriore o patologie del segmento anteriore e la maggior parte dei tumori maligni intraoculari. Il sangue del donatore viene testato per l’HIV-1, HIV-2, epatite B ed epatite C. Il tessuto di un donatore con positività sierologica non viene utilizzato.
Tecnica chirurgica
I trapianti corneali possono essere effettuati eseguendo un’anestesia generale oppure locale associata a una sedazione endovena. Per preparare il tessuto per il trapianto dalla cornea del donatore, il chirurgo perfora un bottone corneale dalla porzione centrale della cornea del donatore utilizzando un trapano o un particolare tipo di laser (Intralase). Per creare il letto ricevente, il chirurgo rimuove il 60-80% della porzione corneale della cornea del ricevente utilizzando un trapano e delle forbici. Il bottone corneale del donatore, che viene trapanato leggermente più grande del letto ricevente, è poi suturato in sede
Gestione postoperatoria
Gli antibiotici topici postoperatori vengono utilizzati per molte settimane e i corticosteroidi topici per molti mesi. In alcuni pazienti, l’astigmatismo corneale può essere ridotto nel primo periodo postoperatorio, mediante un aggiustamento della sutura o una sua rimozione selettiva. Il raggiungimento di un pieno potenziale visivo ha luogo nell’arco di un anno, a causa del cambiamento della rifrazione, della lenta guarigione della ferita e/o dell’astigmatismo corneale. In molti pazienti, una precoce e migliore visione si ottiene mediante una lente a contatto rigida posizionata sul trapianto. Per proteggere l’occhio da traumi accidentali dopo il trapianto, il paziente indossa coppette, occhiali od occhiali da sole. Inoltre, i pazienti vengono avvisati di evitare di piegarsi completamente, di sollevare oggetti pesanti o di sforzarsi.
Complicanze
Le complicanze comprendono le infezioni (intraoculari e corneali), l’emorragia intraoculare, l’apertura della ferita, il glaucoma, il rigetto, il fallimento dell’innesto, l’alto errore rifrattivo (specialmente l’astigmatismo e/o la miopia) e le recidive della malattia, cioè, la distrofia corneale stromale.
Il rigetto non è raro. I pazienti lamentano diminuzione della visione, fotosensibilità, dolore oculare e arrossamento oculare. Il rigetto viene trattato con corticosteroidi, somministrati per via topica (p. es., prednisolone acetato 1% quasi ogni ore), spesso con una iniezione perioculare supplementare (p. es., metilprednisolone 40 mg). Se il rigetto è grave o se la funzione dell’innesto è marginale, corticosteroidi addizionali vengono somministrati per via orale (p. es., prednisone 1 mg/kg/ die) e occasionalmente endovena (p. es., metilprednisolone sodio succinato da 3 a 5 mg/kg una volta). Nella maggior parte degli innesti non ad alto rischio, l’episodio di rigetto è facilmente reversibile e la funzione dell’innesto si ottiene di nuovo pienamente. L’innesto può fallire se il rigetto è insolitamente grave o duraturo o dopo diversi episodi di rigetto. Il reinnesto è possibile, ma la prognosi a lungo termine è inferiore rispetto al primo.
Prognosi
La prognosi di un trapianto corneale trasparente funzionante dipende dalla diagnosi. La possibilità di successo a lungo termine di un trapianto è > 90% per il cheratocono, le cicatrici corneali, la cheratopatia bollosa iniziale o la distrofia corneale stromale, dall’80% al 90% per la cheratopatia bollosa o la cheratite virale non attiva, del 50% per l’infezione corneale attiva e dallo 0 al 50% per i traumi chimici o da radiazione.
L’alto tasso di successo di trapianto corneale è attribuibile a molti fattori, inclusa l’avascolarità della cornea e il fatto che la camera anteriore possiede un drenaggio venoso e non linfatico. Queste condizioni promuovono una zona di bassa tolleranza e un processo attivo detto deviazione immune associata della camera anteriore, in cui si verifica la soppressione dei linfociti intraoculari e l’ipersensibilità ritardata agli antigeni intraoculari trapiantati. Un altro fattore importante è l’efficacia dei farmaci immunosoppressori utilizzati per trattare il rigetto.

